
| 核准日期: | 2008年05月08日 |
| 修改日期: | 2008年07月29日 |
| 2014年01月06日 | |
| 2016年04月21日 | |
| 2020年08月03日 | |
| 2020年08月21日 | |
| 2021年03月15日 |
孟鲁司特钠咀嚼片说明书
请仔细阅读说明书并在医师指导下使用
【药品名称】
通用名称:孟鲁司特钠咀嚼片
英文名称:Montelukast Sodium Chewable Tablets
汉语拼音:Menglusitena Jujuepian
【成份】
本品主要成份为孟鲁司特钠。
化学名称:[R-(E)] -1-[[[1-[3-[2-(7-氯-2-喹啉)乙烯基]苯基]-3-[2-(1-羟基-1-甲基乙基)苯基]丙基]硫]甲基]环丙烷乙酸钠。
化学结构式:
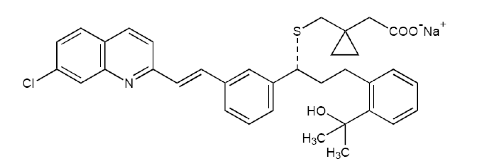
分子式:C35H35ClNNaO3S
分子量:608.18
【性状】本品为粉红色片。
【适应症】
本品适用于2岁至14岁儿童哮喘的预防和长期治疗,包括预防白天和夜间的哮喘症状,治疗对阿司匹林敏感的哮喘患者以及预防运动诱发的支气管收缩。
本品适用于减轻过敏性鼻炎引起的症状(2岁至14岁儿童的季节性过敏性鼻炎和常年性过敏性鼻炎)。
【规格】5mg(以孟鲁司特计)。
【用法用量】
每日一次。哮喘病人应在睡前服用。过敏性鼻炎病人可根据自身的情况在需要时服药。同时患有哮喘和过敏性鼻炎的病人应每晚用药一次。
6至14岁哮喘和/或过敏性鼻炎儿童患者
每日一次,每次一片(5mg)。
2至5岁哮喘和/或过敏性鼻炎儿童患者
每日一次,每次一片(4mg)。
一般建议
以哮喘控制指标来评价治疗效果,本品的疗效在用药一天内即出现。本品可与食物同服或另服。应建议患者无论在哮喘控制还是恶化阶段都坚持服用。
对肾功能不全患者、轻至中度肝损害的患者及不同性别的患者无需调整剂量。
本品与其它哮喘治疗药物的关系
本品可加入患者现有的治疗方案中。
减少合并用药物的剂量:
支气管扩张剂
单用支气管扩张剂不能有效控制的哮喘患者,可在治疗方案中加入本品,一旦有临床治疗反应(一般出现在首剂用药后),根据患者的耐受情况,可将支气管扩张剂剂量减少。
吸入糖皮质激素
对接受吸入糖皮质激素治疗的哮喘患者加用本品后,可根据患者的耐受情况适当减少糖皮质激素的剂量。应在医师指导下逐渐减量。某些患者可逐渐减量直至完全停用吸入糖皮质激素。但不应当用本品突然替代吸入糖皮质激素或遵医嘱。
【不良反应】
本品一般耐受性良好,不良反应轻微,通常不需要终止治疗。本品总的不良反应发生率与安慰剂相似。
原研产品应用于6至14岁儿童哮喘患者
已在大约475名6岁至14岁儿童患者中进行了临床研究,评价了原研产品的安全性。总体上儿童患者使用原研产品的安全性与成人相似,并与安慰剂接近。
在一项安慰剂对照为期8周的临床研究中,原研产品治疗组中与药物相关,发生率>1%且比安慰剂组高的唯一不良事件是头痛,但头痛发生率在两组间无显著差异。
在评价对生长速率的影响的临床研究中,原研产品所表现出儿童用药的安全性特征与以前的描述一致。
累积已有263名6岁至14岁儿童患者使用原研产品治疗至少3个月,164名患者治疗6个月或更长。随着使用原研产品治疗时间的延长,不良事件发生的情况无改变。
原研产品应用于2至5岁儿童哮喘患者
已在大约573名2岁至5岁儿童患者中评价了原研产品的安全性。在一项安慰剂对照为期12周的临床研究中,原研产品治疗组中与药物相关,发生率>1%且比安慰剂组高的唯一不良事件是口渴。但口渴的发生率在两组间无显著差异。
累积已有426名2岁至5岁儿童患者使用原研产品治疗至少3个月,230名患者治疗6个月或更长,63名患者用药12个月或更长。随着使用原研产品治疗时间的延长,不良事件发生的情况无改变。
原研产品应用于2至14岁季节性过敏性鼻炎儿童患者
在一项为期2周的安慰剂对照临床研究中,已在280名2至14岁季节性过敏性鼻炎患者中评价了原研产品的安全性。每天晚间服用原研产品一次耐受性良好,不良反应发生率与服用安慰剂组类似。在这项研究中,原研产品治疗组的不良反应发生率低于1%,且未发现有与药物相关,发生率高于安慰剂组的不良反应。
原研产品临床实践的合并分析
使用有效的自杀行为评估方法对41项安慰剂对照临床研究(35项研究针对15岁及以上患者;6项研究针对6-14岁儿童患者)进行了合并分析。在9929例服用原研产品的患者和7780例服用安慰剂的患者中,一例有自杀意念的患者服用了原研产品。任何一组均未出现完成自杀、自杀企图或针对自杀行为的预备行动。
针对46项安慰剂对照临床研究(35项研究针对15岁及以上患者,11项研究针对3个月至14岁的儿童患者)进行了独立的合并分析,评估行为相关性不良事件。在11673例服用原研产品的患者和8827例服用安慰剂的患者中,行为相关性不良事件的发生率分别为2.73%和2.27%;比值比为1.12(95%Cl [0.93;1.36])。
这些合并分析中包含的临床试验没有特定设计自杀率或行为相关性不良事件的检查。
原研产品上市后的经验
原研产品上市使用后有以下不良反应报告:
感染和传染:上呼吸道感染。
血液和淋巴系统紊乱:出血倾向增加、血小板减少症。
免疫系统紊乱:包括过敏反应的超敏反应、十分罕见的肝脏嗜酸性粒细胞浸润。
精神系统紊乱:包括攻击性行为或敌对性的兴奋、焦虑、抑郁、方向知觉丧失、注意力不集中、夜梦异常、口吃(结巴)、幻觉、失眠、记忆损伤、强迫症状、精神运动过激(包括易激惹、烦躁不安和震颤)、梦游、自杀的想法和行为(自杀)、抽搐。
神经系统紊乱:眩晕、嗜睡、感觉异常/触觉减退及十分罕见的癫痫发作。
心脏紊乱:心悸。
呼吸,胸腔和纵隔系统紊乱:鼻衄;肺嗜酸性粒细胞增多症。
胃肠道紊乱:腹泻、消化不良、恶心、胰腺炎、呕吐。
肝胆紊乱: ALT和AST升高、十分罕见的肝炎(包括胆汁淤积性,肝细胞和混合型肝损害)。
皮肤和皮下组织紊乱:血管性水肿、挫伤、多形性红斑、结节性红斑、瘙痒、皮疹、史蒂文斯—约翰逊综合征/中毒性表皮坏死松解症、荨麻疹。
肌肉骨骼和结缔组织紊乱:关节痛、包括肌肉痉挛的肌痛。
肾和泌尿系统紊乱:儿童遗尿症(偶见)
其他紊乱和给药部位情况:衰弱/疲劳,水肿,发热。
【禁忌】对本品中的任何成份过敏者禁用。
【注意事项】
口服本品治疗急性哮喘发作的疗效尚未确定。因此,不应用于治疗急性哮喘发作。应告知患者准备适当的抢救用药。
虽然在医师的指导下可逐渐减少合并使用的吸入糖皮质激素剂量,但不应用本品突然替代吸入或口服糖皮质激素。
接受包括白三烯受体拮抗剂在内的抗哮喘药物治疗的患者,极少病例发生以下一项或多项情况:嗜酸性粒细胞增多症、血管性皮疹、肺部症状恶化、心脏并发症和/或神经病变(有时诊断为Churg-Strauss综合征——一种全身性嗜酸细胞性血管炎)。这些情况有时与减少或停用口服糖皮质激素治疗有关。虽然这些情况与白三烯受体拮抗剂的因果关系尚未确定,但建议对服用本品的患者加以注意并作适当的临床监控。
应告知苯丙酮尿症患者,4 mg和5 mg咀嚼片分别含有0.674和0.842 mg苯丙氨酸(阿斯巴甜的组分)。
孟鲁司特可能对驾驶和操纵机器的能力无影响或存在微小的影响。然而,有个别嗜睡和头晕的报道。
据报道,服用孟鲁司特钠咀嚼片的成人、青少年和儿童患者可出现神经精神事件。服用原研产品的上市后报告包括兴奋、攻击行为或敌意、焦虑、抑郁症、定向力障碍、注意力障碍、梦境异常、幻觉、失眠、易怒、记忆缺陷、不安、梦游症、自杀念头和行为(包括自杀)、抽搐和震颤。有关原研产品的一些上市后报告的临床细节似乎与药物引起的效应一致。
服用原研产品的患者有精神神经事件的报道(见不良反应)。由于其他因素也可能导致这些事件,因此不能确认是否与原研产品相关。医生应与患者和/或护理人员探讨这些不良事件。患者和/或护理人员应被告知,如果发生这些情况,应通知医生。
已知对阿司匹林敏感的患者在服用本品时应继续避免使用阿司匹林或非甾体抗炎药。
【孕妇及哺乳期妇女用药】
除非明确需要服药,孕妇应避免服用本品。
已有数据显示,已发表的评价妊娠妇女使用孟鲁司特的重大出生缺陷的前瞻性和回顾性队列研究并未确立药物相关性风险。现有的研究在方法上有一定的局限性,包括样本量太小,有些是回顾性数据收集,以及不一致的比较组。
尚不明确本品是否能从乳汁分泌。由于许多药物均可从乳汁分泌,哺乳期妇女应慎用本品。
【儿童用药】
原研产品已在6个月至14岁的儿童中进行了安全性和有效性研究,6个月以下儿童患者的安全性和有效性尚未研究。
研究表明本品不会影响儿童的生长速率。
【老年用药】不适用。
【药物相互作用】
本品可与其它一些常规用于哮喘的预防和长期治疗及治疗过敏性鼻炎的药物合用。在药物相互作用研究中,推荐剂量的本品不对下列药物产生有临床意义的药代动力学影响:茶碱、泼尼松、泼尼松龙、口服避孕药(乙炔雌二醇/炔诺酮35/1)、特非那定、地高辛和华法林。
甲状腺激素、镇静类安眠药、非甾体类抗炎药、苯二氮卓类药物和减充血剂:虽然没有进行额外的特定的相互作用研究,但本品与临床研究中广泛使用的常见处方药物联用,没有临床不良相互作用的证据。这些药物包括甲状腺激素、镇静类安眠药、非甾体类抗炎药、苯二氮卓类药物和减充血剂。
在合并使用苯巴比妥的患者中,孟鲁司特的血浆浓度-时间曲线下面积(AUC)减少大约40%。由于孟鲁司特通过CYP 3A4、2C8和2C9代谢,因此孟鲁司特应谨慎与CYP 3A4、2C8和2C9诱导剂(如苯妥英钠、苯巴比妥、利福平)同时服用,特别是儿童。但是不推荐调整本品的使用剂量。
体外试验表明孟鲁司特是CYP 2C8的抑制剂。然而,一项关于孟鲁司特和罗格列酮(一种主要通过CYP 2C8代谢的典型探测底物)药物相互作用的临床研究数据表明,孟鲁司特在体内对CYP 2C8没有抑制作用。因此认为孟鲁司特不会对通过这种酶代谢的药物(例如:紫杉醇、罗格列酮、瑞格列奈)产生影响。
体外研究表明,孟鲁司特是CYP 2C8、2C9和3A4的底物。一项涉及孟鲁司特和吉非贝齐(CYP 2C8和2C9的抑制剂)药物间相互作用的临床研究证明,吉非贝齐能使孟鲁司特的全身暴露水平增加4.4倍。CYP 3A4的强效抑制剂----伊曲康唑,与吉非贝齐和孟鲁司特同时给药后不会进一步增加孟鲁司特的全身暴露水平。在临床安全性研究中,使用了大于在成人中批准的10mg的剂量(例如连续22周给予成人患者200mg/天的剂量,以及连续大约一周给予患者最高为900mg/天的剂量),没有观察到有临床意义的不良事件,基于这样的数据,吉非贝齐对孟鲁司特全身暴露水平的影响被认为是不具有临床意义的。因此,与吉非贝齐同时给药,无需调整孟鲁司特的剂量。根据体外数据,孟鲁司特与其他已知的CYP 2C8抑制剂(例如甲氧苄啶)之间预计不会发生有临床意义的药物相互作用。此外,仅孟鲁司特与伊曲康唑同时给药不会显著增加前者的全身暴露水平。
【药物过量】
尚无关于临床治疗中本品过量的专门资料。在治疗慢性哮喘的研究中,成年患者使用的剂量高达每日200mg,连续用药22周及短期研究中使用的剂量高达每日900mg,连续用药约1周,均未出现有临床意义的不良事件。如果过量服药,采取常规支持措施是合理的;例如,从胃肠道清除未吸收的物质,实施临床监测,并且如果需要,进行支持性治疗。
已有上市后急性药物过量的报道和使用原研产品的临床研究。其中包括成人和儿童使用高达1000mg剂量的报道。临床和实验室发现均一致显示了其在成人和儿童患者的安全性。在大部分药物过量的报告中,没有不良事件。最常发生的不良事件与安全性特征一致,包括腹痛、嗜睡、口渴、头痛、呕吐和精神运动过度。
尚不清楚本品是否能经腹膜或血液透析清除。
【药理毒理】
药理作用
半胱氨酰白三烯(LTC4,LTD4,LTE4)是花生四烯酸的代谢产物,由包括肥大细胞和嗜酸性粒细胞在内的多种细胞释放。这些类花生酸类物质与半胱氨酰白三烯(CysLT)受体结合。I型半胱氨酰白三烯(CysLT1)受体分布于人体的气道(包括气道平滑肌细胞和气道巨噬细胞)和其他的促炎症细胞(包括嗜酸性粒细胞和某些骨髓干细胞)。孟鲁司特对CysLT1受体有高度的亲和性和选择性(与其它有药理学重要意义的气道受体如类前列腺素、胆碱能和b-肾上腺能受体相比)。孟鲁司特抑制LTD4与CysLT1受体结合所产生的生理效应而无任何受体激动活性。
毒理研究
遗传毒性
孟鲁司特钠在体外微生物突变试验、V-79哺乳动物细胞突变试验、大鼠肝细胞碱洗脱试验、中国仓鼠卵巢细胞染色体畸变试验和小鼠骨髓染色体畸变试验中,结果均为阴性。
生殖毒性
雌性大鼠经口给予孟鲁司特钠200mg/kg/天(估算暴露量为成人每日最大推荐口服剂量(maximum recommended daily oral dose,MRHDOD)AUC的70倍),可见生育力和生殖力指数降低。雌性大鼠经口给予100mg/kg/天(估算暴露量约为成人MRHDOD AUC的20倍),未见对生育力和生殖能力的影响。雄性大鼠经口给予达800mg/kg/天(估算暴露量约为成人MRHDOD AUC的160倍),未见对生育力的影响。
在胚胎-胎仔发育研究中,大鼠(妊娠6-17天)、兔(妊娠6-18天)于器官发生期经口给予孟鲁司特钠,剂量分别达400、300mg/kg/天(分别相当于成人MRHDOD AUC的100、110倍),未见对胚胎-胎仔发育的任何不良影响。
致癌性
大鼠经口给药剂量达200mg/kg/天(估算暴露量分别约为成人、儿童MRHDOD AUC的120、75倍)2年、小鼠经口给药剂量达100mg/kg/天(估算暴露量分别约为成人、儿童每日MRHDOD AUC的45、25倍)92周的研究中,均未见致癌性。
【药代动力学】
吸收
孟鲁司特口服吸收迅速而完全。成人空腹服用5mg咀嚼片后于2至2.5小时达到Cmax。平均生物利用度为73%。食物对孟鲁司特钠的长期使用无重要的临床影响。
2~5岁的儿童患者空腹服用4mg咀嚼片后于2小时达到Cmax。
分布
99%以上的孟鲁司特钠与血浆蛋白结合。孟鲁司特的稳态分布容积平均为8~11升。同位素标记的孟鲁司特在大鼠中的研究显示,只有极少量的孟鲁司特通过血脑屏障。而且,在用药后24小时,所有其它组织中的放射标记物量也极少。
代谢
孟鲁司特几乎被完全代谢。在使用治疗剂量的研究中,成人和儿童稳态情况下,血浆中未测出孟鲁司特的代谢物。
在体外使用人肝微粒体进行的研究显示,细胞色素P450 3A4和2C9与孟鲁司特的代谢有关。根据体外人肝微粒体的进一步研究结果,孟鲁司特治疗剂量的血浆浓度不抑制细胞色素P450 3A4、2C9、1A2、2A6、2C19或2D6。
排泄
在健康成人中,孟鲁司特的平均血浆清除率为45mL/分。口服同位素标记的孟鲁司特后,在随后5天采集的大便中检测出86%的放射活性,尿中测出的量<0.2%。结合孟鲁司特口服生物利用度考虑,孟鲁司特及其代谢物几乎全部经由胆汁排泄。
在健康青年中进行的许多研究显示孟鲁司特平均血浆半衰期为2.7~5.5小时。在口服剂量高至50mg的范围内,孟鲁司特的药代动力学近似线性关系。未发现清晨和夜间服用孟鲁司特的药代动力学有差异。每天一次服用10mg孟鲁司特,血浆中只有极少量的原药积聚(~14%)。
特殊患者
对老年人、肾功能不全的患者或轻至中度肝功能不全的患者无需调整剂量。尚无严重肝功能不全(Child-Pugh评分>9分)的患者使用孟鲁司特的临床资料。
【贮藏】遮光,密封,在常温(10~30℃)干燥处保存。
【包装】双铝包装。6片/盒,12片/盒,18片/盒,24片/盒。
【有效期】36个月。
【执行标准】国家药品监督管理局标准YBH10622020。
【批准文号】国药准字H20083330。
【药品上市许可持有人】
名 称:鲁南贝特制药有限公司
注册地址:山东省临沂市红旗路209号
【生产企业】
企业名称:鲁南贝特制药有限公司
生产地址:山东省临沂市银雀山路243号
邮政编码:276006
电话号码:0539-8336336(销售部)8336169(质管部)
传真号码:0539-8336338
网 址:www.LUNAN.com.cn